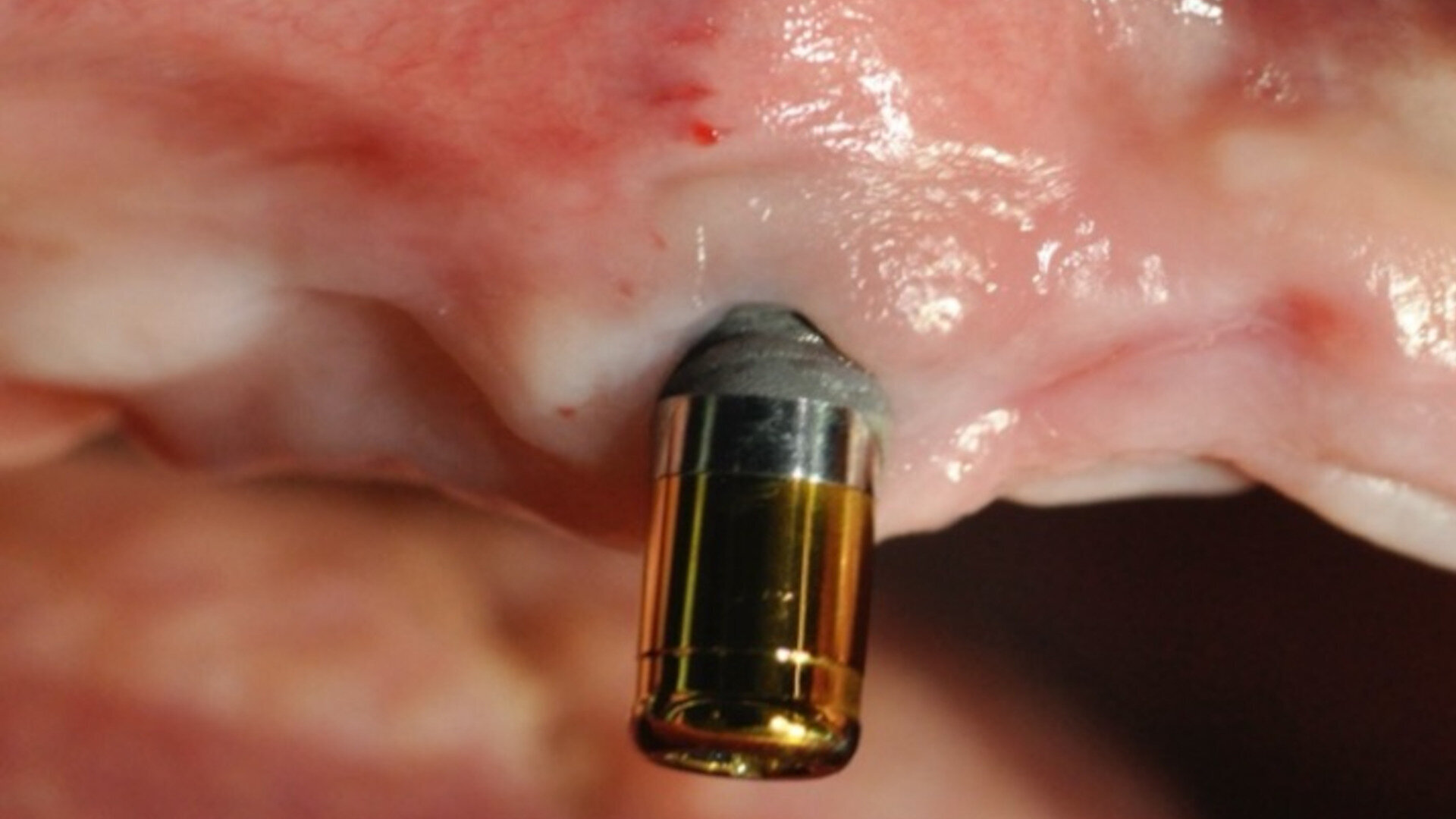
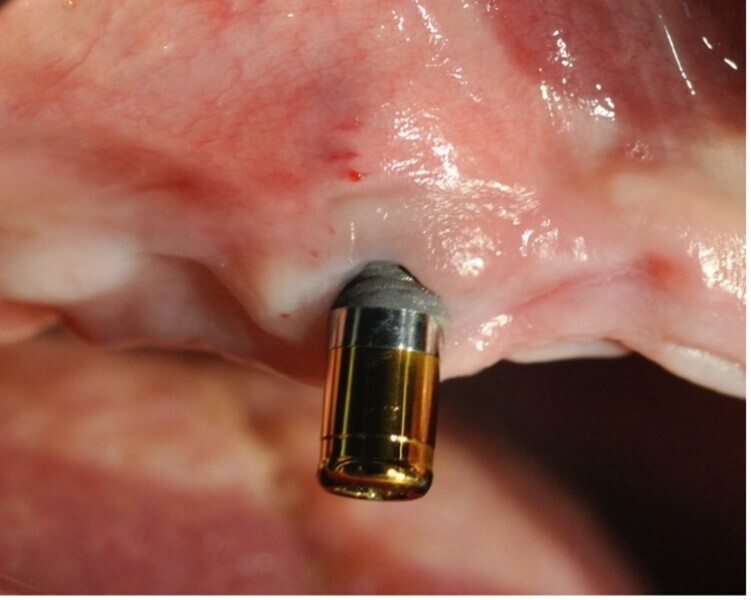
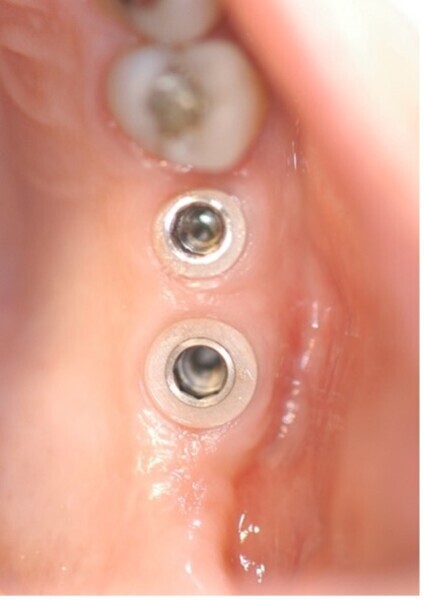
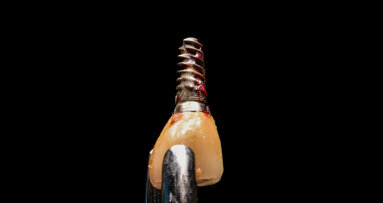
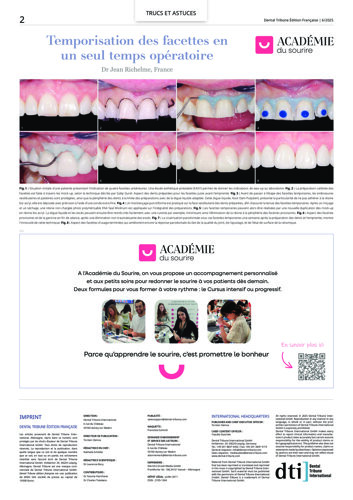
Le succès implantaire à court terme est matérialisé par la bonne intégration tissulaire des implants et notamment L’ostéointégration, il est le fruit d’un concept global de bonne pratique clinique. En revanche, à long terme, des problèmes bio-physico-chimiques auxquels sont soumis les implants dans la cavité orale, peuvent constituer des facteurs de risques qui ont été ignorés, ou négligés, mais qui ont leur importance dans le succès de nos restaurations implantaires. L’inflammation péri implantaire et l’électrogalvanisme7 sont des facteurs de risques qui peuvent contribuer à la corrosion des implants dentaires métalliques et compromettre leur pronostic (Fig. 1).

Fig. 1 : La biocorrosion des implants et des couronnes sur base métallique. L’électro-galvanisme un réel facteur de risque pour le pronostic des restaurations dentaires.
Prendre conscience de ces problèmes de corrosion et bien les connaître peut être une des clés dans la stratégie de lutte contre les péri-implantites.
Une étude clinique prospective pour le moins préoccupante mentionne la présence de particules métalliques dans 75 % des biopsies de tissus atteints de péri-implantite.8 Ceci révèle un concept émergeant de relargage de particules métalliques dans l’environnement des implants dentaires, elles ont des effets cytoxiques et peuvent constituer un facteur de risque des péri-implantites sur le long terme.9
La notion d’immunointégration est évoquée pour garantir la stabilité biologique des implants dans le temps
Ces particules métalliques sont liées à la corrosion des implants en titane qui a été observée dans de nombreuses études.
Nous voudrions dans cet article mettre en relief ces phénomènes de corrosion métallique dans la cavité orale: évoquer leur étiologie, les facteurs de risque et les moyens de prévention.
Nous voudrions souligner l’intérêt que peuvent avoir les implants zircone comme alternative préventive aux implants en titane dans la lutte contre les péri-implantites.
Étiologie de la corrosion des implants en titane
Le terme de bio-tribocorrosion10 est évoqué pour définir les phénomènes de nature électro-biochimiques qui se produisent autour des implants métalliques dans la cavité orale. C’est la combinaison d’évènements mécaniques qui touchent les implants liés à l’usure, la friction, et la lubrification des surfaces implantaires, et d’évènements biologiques liés au microbiote buccal et sa biochimie qui induit des phénomènes d’oxydation des surfaces implantaires en titane qui ne sont pas neutre sur le plan électrochimique.
Gaur et al. , dans une revue portant sur 34 articles10 montrent que des facteurs comme le type de titane, la nature des biofilms, le pH salivaire et intercellulaire, le taux de fluor et les micromouvements durant la mastication favorisent la bio-tribocorrosion des implants en titane.
Pour rappel, selon l’ASTM (American Society for Testing and Materials), il y a cinq grades de titane. Les grades de I-IV considérés comme du titane commercialement pur (CpTi).
Ces quatre premiers grades ont des puretés variables en titane avec l’inclusion de différents éléments interstitiels comme le fer, l’oxygène, l’azote, le carbone. Le titane de grade V est un alliage Ti6Al4V. Ces différents grades de titane ont été conçus pour améliorer les propriétés biomécaniques de Ti mais l’introduction d’autres éléments chimiques dans la structure du matériau altère sa résistance à la corrosion.
Même si le titane et ses alliages sont considérés comme les matériaux d’implants les plus biocompatibles en raison de leurs caractéristiques biochimiques nobles, l’usure et la corrosion se produisent toujours, en particulier dans un environnement extrême tel que l’environnement buccal.
Le TiCp et le Ti6Al4V sont considérés comme les matériaux idéaux pour les implants dentaires en raison de leur propriété d’intégration osseuse, de leur biocompatibilité élevée et de leurs excellentes propriétés mécaniques.11
Le Ti (Cp TiO2) et Ti6Al4V ne sont pas neutre sur le plan électrochimique. La zircone ZrO2 YSZ apparaît plus stable.12
Il se forme à la surface du Ti une couche de TiO2 hautement résistante à l’environnement agressif et préventif du décapage anodique du substrat. Cependant dans le corps humain, les fluides extracellulaires et le sang contiennent des solutions aqueuses de certaines substances organiques, de l’oxygène dissous, divers anions inorganiques (Cl-, HPO42–HCO3–) et des cations (Na+, K+, Ca2+, Mg2+) ainsi que des acides aminés et des protéines qui peuvent dégrader la couche de TiO2.13
Dans l’environnement buccal, les facteurs liés à chaque individu, y compris les processus métaboliques, immunologiques, microbiologiques et biochimiques, ont également un impact sur la détérioration de la surface de l’implant dentaire.14, 15
Des facteurs variables comme l’alimentation, les processus pathologiques, les traitements médicamenteux, influencent la composition salivaire. En l’occurrence un pH salivaire bas généré par les boissons acidifiantes (soda) ou par des processus inflammatoires chroniques et infectieux, favorise la corrosion du Ti.
De plus, Ossowska13 mentionnent que les fluorures contenus dans les pâtes dentifrice altèrent la couche d’oxide protectrice à la surface des implants en Ti, les exposant ainsi également à une accélération du processus de corrosion.
Ces phénomènes électrochimiques qui touchent les implants en titane insérés dans l’environnement buccal génèrent des particules nanométriques et micrométriques qui diffusent dans l’environnement péri-implantaire et à distance dans tout le corps, pouvant avoir de nombreux effets biologiques.
Les particules ioniques issues de la corrosion du Ti et de ses alliages initient une réponse inflammatoire dans les tissus environnant l’implant.16
Des ions Ti ont été détectés dans les cellules épithéliales et les macrophages sur des examens cytologiques exfoliatifs de tissus péri-implantaires.17 Ils causent des ostéolyses aseptiques, même à faible concentration contribuant à une perte prématurée des implants et des péri-implantites.14, 31
Dini and Mathew14, 16 montrent que dans la cavité orale, des pathogènes comme Streptococcus mutans (terrain carieux) et Porphyromonas gingivalis (pathologie parodontale) attaquent la couche protectrice de TiO2 et induisent des phénomènes de corrosion. Ils produisent des lipopolysaccharides (LPS) et des acides qui abaissent le pH. Ces deux facteurs agissent en synergie dans le micro-environnement osseux des implants en titane et génèrent une biocorrosion qui peut dégrader la surface du titane.
Au-delà de ces phénomènes électrochimiques, avec les conséquences biologiques que nous venons d’évoquer, les implants en titane sont également soumis à des contraintes mécaniques qui sont à l’origine d’une tribocorrosion.
Gaur et al.,10 dans un article de revue et une étude in vitro ont montré que sur le plan mécanique, l’alliage de titane Ti6AlV4 est plus susceptible à la corrosion que le TiCp sous contrainte mécanique d’usure et de friction. Ils concluent que la zircone ZrO2 n’est pas susceptible à la tribocorrosion.
Facteurs influençant la bio-tribocorrosion
Le type d’alliage de titane
Le Ti existe sous deux formes, la phase alpha à température ambiante et la phase bêta.18 La structure alpha contient plus d’oxydes de surface, ce qui lui confère une biocompatibilité supérieure, tandis que la phase bêta, qui contient moins d’oxydes de surface, est plus résistante. Le CpTi (grades 1 à 4) comprend principalement des grains de phase alpha, ce qui le rend plus biocompatible, tandis que l’alliage Ti6Al4V (grade 5) est un alliage à double phase alpha/bêta auquel on a ajouté du vanadium qui stabilise la phase bêta plus étendue. Comme l’alliage Ti6Al4V présente des oxydes de surface moins abondants, il est plus sensible à la corrosion.18 En outre, il est dur et cassant, ce qui augmente sa susceptibilité à la tribocorrosion.19
L’alliage TiZr (Roxolid) a une structure alpha binaire car le Zr a une transformation allotropique et une température de transition de phase identiques à celles du Ti. Il a une taille de grain plus petite avec plus d’oxydes de surface, ce qui améliore sa résistance à la corrosion par rapport au Ti6Al4V.18 D’autres alliages comme Ti13Nb13Zr ont un taux d’usure plus élevé que CpTi et une re-passivation réduite. L’alliage NiCr présente une meilleure résistance à la corrosion que les alliages CpTi et Ti6Al4V.20, 21
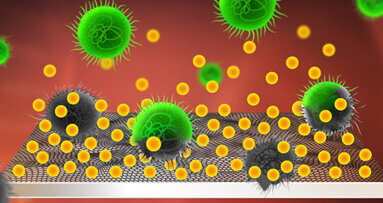
Les biofilms oraux
Kip et al.22 montrent que les principaux types de bactéries associées à la corrosion des métaux sont les bactéries sulfato-réductrices, les bactéries oxydantes du soufre, les oxydants du fer, les réducteurs du fer, les oxydants du manganèse et autres microbes. Ils sécrètent des acides organiques et des substances polymériques extracellulaires qui dégradent la surface du métal.
La salive est ses constituants dans la cavité orale sont un excellent environnement pour les biofilms et en particulier dans le micro-gap des systèmes implantaires bone level. Les agents pathogènes s’accumulent et pénètrent jusqu’à des espaces d’environ 10 μm au niveau des interfaces des implants.14 Ils induisent des piqûres de corrosion qui contribuent à détériorer la surface de l’implant en titane.
Ces phénomènes microbiologiques sont induits par deux mécanismes:
- La dissolution métallique par les acides organiques produit lors du catabolisme du sucre par la flore bactérienne qui induit une diminution du pH.
- Le développement de biofilms qui crée des différences de potentiel en oxygène à la surface des implants.23
Des études in vitro23, 24montrent que des pH bas et une immersion prolongée dans la salive ainsi qu’un mouvement mécanique et un contact avec des métaux dissemblables, renforçaient le processus de dissolution du métal.
Les niveaux différentiels d’oxygène à la surface du Ti génèrent des zones moins oxygénées qui agissent comme des anodes. Elles subissent une corrosion en creux et libèrent des ions métalliques dans la salive. Avec les produits finaux bactériens et notamment les ions chlorure, cela favorise la dégradation du métal.23
Les colonisateurs primaires Streptococcus mutans (S. mutans), Streptococcus gordonii (S. gordonii) et Lactobacilli et tardifs (P. gingivalis) ainsi que les organismes de liaison Fusobacterium nucleatum (F. nucleatum) du biofilm buccal provoquent de la corrosion. Les colonisateurs primaires produisent de l’acide lactique, du péroxide d’hydrogène et de l’acide formique qui diminue le pH.25
Les colonisateurs tardifs produisent des LPS qui dégradent le TiO2 et augmentent la réponse inflammatoire des tissus.27 Ils modifient l’état d’oxydation du Ti et corrodent sa surface en l’absence de charges mécaniques.
Ces phénomènes de corrosion liés aux biofilms sont amplifiés sur les surfaces rugueuses dans la mesure où l’on observe une augmentation de la biomasse sur ce type de surface.25 Nous comprenons par cette approche microbiologique de la corrosion pourquoi les implants rugueux dans un contexte de parodontite ou d’antécédent de parodontite peuvent avoir un pronostic défavorable.17
pH acide et fluorures
Le pH acide de la salive dû au métabolisme alimentaire, thérapeutique ou bactérien joue un rôle important dans la bio-tribocorrosion des implants dentaires. Les modifications de l’écologie l’homéostasie de l’écosystème oral peut modifier les propriétés physico-chimiques et aboutir à la production excessive d’acide. Les acides lactique, chlorhydrique et fluorhydrique (HF) sont principalement impliqués dans la corrosion.29
Ces situations sont notamment rencontrées dans les cas de parodontites, toutes les situations où le débit salivaire diminue (tabac, stress, traitement médicamenteux et modifications hormonales) et/ou la qualité de la salive peut être altérée (mauvaise habitude alimentaire, traitements médicamenteux, et pathologie des glandes salivaires) : le problème et multifactoriel avec des facteurs de risques locaux, environnementaux et systémiques.
La couche de passivation TiO2, Al2O3, V2O3 réagit avec les fluorures en fonction du temps d’exposition et de la concentration en formant un complexe soluble Ti-F incluant NaTiF6, TiCl6, et TiF6. Ces réactions chimiques augmentent la porosité du métal et diminuent sa résistance à la corrosion.30
Les implants soumis aux cycles de mastications et aux variations de pH voient leur résistance à la corrosion s’altérer dans le temps et subissent des attaques acides d’origine multifactorielles difficiles à contrôler. L’utilisation de fluorure dans le gel prophylactique ou les dentifrices est à contrôler strictement en présence d’implant en titane et notamment dans un contexte de polymétallisme. Des mesures du pH salivaire sont recommandées et l’utilisation des concentrations de fluorure supérieures à 1 000 ppm sont à proscrire dans ces situations.31, 32
Cycle masticatoire
Dans la cavité buccale, les implants dentaires sont exposés à des charges occlusales cycliques pendant l’activité masticatoire, ce qui génère des contraintes mécaniques sur les composants prothétiques et peut entraîner à long terme des micro-mouvements.33
- Les micro-mouvements éliminent la couche de TiO2 et affectent l’interface implant-os et les composants internes tels que le pilier, les vis et les couronnes.33–35 Ce processus de détérioration accélérée de la surface à l’interface de matériaux en contact soumis à des mouvements oscillatoires de faible amplitude est appelé fretting.36 L’entrée et la sortie de la salive l’accélèrent entre l’implant et la superstructure en alliage, créant des zones de potentiel d’oxygène différentiel qui favorisent la corrosion.29, 37 Dans les zones de faible concentration en oxygène, la surface devient anodique. Comme la corrosion est directement proportionnelle au rapport entre la cathode et l’anode, la dissolution est accélérée lorsque l’anode est de faible dimension.37
En présence de parafonctions, des forces occlusales multidirectionnelles de différentes intensités et fréquences agissent sur les implants dentaires et perturbent la couche de TiO2.
La salive
La salive agit comme un lubrifiant mais les protéines qu’elle contient comme la mucine par exemple forment un réseau physiquement réticulé qui favorise un effet viscoélastique sur le Ti et s’oppose aux surfaces de glissement.38, 39 En outre, les protéines comme l’albumine s’adsorbent sur les matériaux prothétiques, ce qui réduit l’usure et la friction.
La balance entre ces deux phénomènes influence l’effet lubrifiant et protecteur de la salive et contribue à la tribocorrosion des implants.
Cytotoxicité du titane et des particules métalliques
Accumulation de particules métalliques dans les tissus péri-implantaire

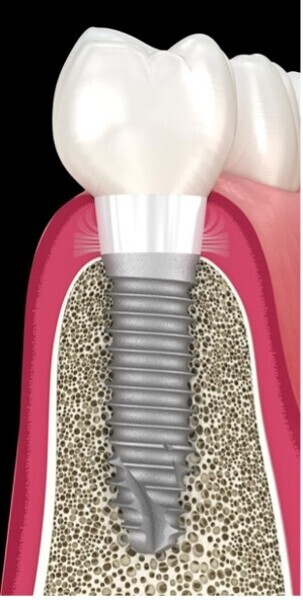
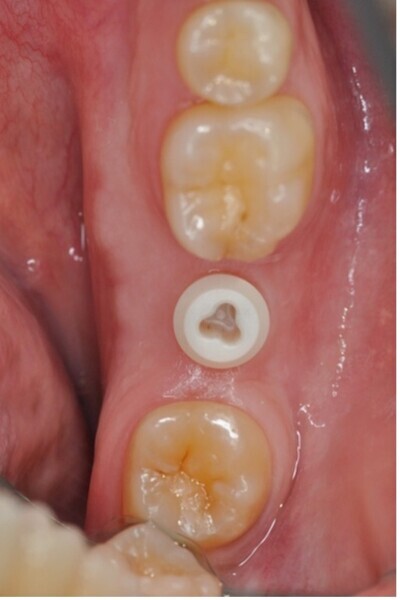
Fig. 2 : Particules métalliques retrouvés dans les tissus mous et l’os, d’un site où un implant atteint de péri-implantite a été retiré.
Les microparticules de Ti relarguées par les implants dentaires en raison de la bio-tribocorrosion peuvent s’accumuler dans les tissus locaux.40, 41 Ces phénomènes constituent localement un facteur de risque des péri-implantites et peuvent potentiellement poser d’importants troubles de santé. Le taux de Ti dans le corps ne devrait pas dépasser 15 mg par 70 kg de poids corporel chez un individu en bonne santé.40 Ces concentrations durent de quelques heures à plusieurs mois car le Ti est très insoluble et difficilement éliminé de l’organisme.40, 42, 43 Les particules de Ti détruisent l’homéostasie intra-épithéliale de la bouche, favorisent l’inflammation des tissus péri-implantaires et affectent les ostéoblastes et les ostéoclastes, ce qui entraîne une perte osseuse autour des implants.40
Les ions Ti augmentent la sensibilité des cellules épithéliales gingivales aux micro-organismes et favorisent l’infiltration des monocytes dans la cavité buccale, ce qui entraîne une cytotoxicité et une inflammation à l’interface entre l’implant et le tissu gingival.44
Il a été remarqué la présence de particules Ti de 1 à 10 μm de diamètre libérées lors de l’élimination de biofilm autour des implants dentaire (Fig. 2). Ces particules sont cytotoxiques pour les fibroblastes.45
Dans une étude in vitro sur les effets cytotoxiques du CpTi et de son alliage Al4V Chandar et al. ont montré une différence. Les fibroblastes gingivaux humains ont montré une meilleure viabilité cellulaire avec le CpTi. L’aluminium et le vanadium contenus dans l’alliage Ti6Al4V provoque une cytotoxicité.46



 Autriche / Österreich
Autriche / Österreich
 Bosnie Herzégovine / Босна и Херцеговина
Bosnie Herzégovine / Босна и Херцеговина
 Bulgarie / България
Bulgarie / България
 Croatie / Hrvatska
Croatie / Hrvatska
 République tchèque et Slovaquie / Česká republika & Slovensko
République tchèque et Slovaquie / Česká republika & Slovensko
 France / France
France / France
 Allemagne / Deutschland
Allemagne / Deutschland
 Grèce / ΕΛΛΑΔΑ
Grèce / ΕΛΛΑΔΑ
 Hongrie / Hungary
Hongrie / Hungary
 Italie / Italia
Italie / Italia
 Pays-Bas / Nederland
Pays-Bas / Nederland
 Nordique / Nordic
Nordique / Nordic
 Pologne / Polska
Pologne / Polska
 Portugal / Portugal
Portugal / Portugal
 Roumanie & Moldavie / România & Moldova
Roumanie & Moldavie / România & Moldova
 Slovénie / Slovenija
Slovénie / Slovenija
 Serbie et Monténégro / Србија и Црна Гора
Serbie et Monténégro / Србија и Црна Гора
 Espagne / España
Espagne / España
 Suisse / Schweiz
Suisse / Schweiz
 Turquie / Türkiye
Turquie / Türkiye
 Royaume-Uni et Irlande / UK & Ireland
Royaume-Uni et Irlande / UK & Ireland
 International / International
International / International
 Brésil / Brasil
Brésil / Brasil
 Canada / Canada
Canada / Canada
 Amérique latine / Latinoamérica
Amérique latine / Latinoamérica
 États-Unis / USA
États-Unis / USA
 Chine / 中国
Chine / 中国
 Inde / भारत गणराज्य
Inde / भारत गणराज्य
 Pakistan / Pākistān
Pakistan / Pākistān
 Vietnam / Việt Nam
Vietnam / Việt Nam
 ANASE / ASEAN
ANASE / ASEAN
 Israël / מְדִינַת יִשְׂרָאֵל
Israël / מְדִינַת יִשְׂרָאֵל
 Algérie, Maroc et Tunisie / الجزائر والمغرب وتونس
Algérie, Maroc et Tunisie / الجزائر والمغرب وتونس
 Moyen-Orient / Middle East
Moyen-Orient / Middle East





















































To post a reply please login or register