Après avoir expliqué les principes physiques fondamentaux du laser et ses effets sur les bactéries et les surfaces dentinaires, la seconde partie de cet article porte sur l’analyse de quelques recherches parmi les plus importantes, publiées dans la littérature internationale actuelle. Elle examine également les nouvelles lignes directrices concernant l’utilisation du laser, comme source d’activation de produits chimiques d’irrigation.
_Endodontie assistée par laser
Préparation de la cavité d’accès
La cavité d’accès peut être préparée directement avec les lasers Erbium, qui sont capables d’éliminer l’émail et la dentine. Dans ce cas, il est recommandé d’utiliser un embout constitué d’un tube court (4 à 6 mm) en quartz, d’un diamètre de 600 à 800 μm, afin de disposer d’une énergie et d’une puissance plus élevées. C’est une technique dont l’importance ne doit pas être sous-estimée. En raison de son affinité pour les tissus les plus riches en eau (la pulpe et les tissus carieux), le laser permet d’accéder à la chambre pulpaire avec un minimum de traumatisme (grâce à sa sélectivité). Simultanément, il est possible d’éliminer les débris bactériens et de décontaminer le tissu pulpaire. Après la réduction des populations bactériennes, l’accès aux entrées canalaires peut être efficacement préparé, sans transposition des micro-organismes, des toxines et des débris, en direction apicale durant la procédure. Chen et al. ont démontré que les bactéries sont tuées pendant la préparation cavitaire jusqu’à une profondeur de 300 à 400 μm, sous la surface exposée au rayonnement.20 De plus, les lasers Erbium se révèlent utiles pour éliminer les pulpolithes et rechercher les canaux calcifiés.
Préparation et mise en forme des canaux
La préparation des canaux avec des instruments en nickel-titane (NiTi), reste à l’heure actuelle la norme de référence en endodontie. En effet, malgré l’effet ablatif bien connu des lasers Erbium (2 780 et 2 940 nm) sur les tissus durs, leur efficacité pour préparer les canaux radiculaires se révèle insuffisante pour le moment, et ne satisfait pas aux critères endodontiques atteints par la technologie nickel-titane (NiTi).21–23 Les lasers Erbium-Chrome:YSGG (Er,Cr:YSGG) et Erbium:YAG (Er:YAG) ont toutefois reçu l’approbation de la FDA (le Secrétariat américain aux produits alimentaires et pharmaceutiques) pour le nettoyage, la mise en forme et l’élargissement des canaux. Selon quelques études, ces procédures ont pu être efficacement réalisées avec ces types de laser. Shoji et al. ont utilisé un laser Er:YAG équipé d’un tube de forme conique, à émission à la fois latérale (80 %) et frontale (20 %), pour élargir et nettoyer les canaux (10 à 40 mJ et 10 Hz). Ils ont obtenu des surfaces dentinaires plus propres par comparaison avec les techniques classiques à instruments rotatifs.24
Dans une étude préliminaire sur les effets d’un laser Er:YAG équipé d’une microsonde de 200 à 400 μm à émission radiale, Kesler et al. ont conclu que le dispositif permettait un élargissement et une mise en forme beaucoup plus rapides et efficaces que la méthode traditionnelle. Les examens des photos prises au microscope électronique à balayage (SEM) ont révélé une surface dentinaire uniformément propre sur le haut de la partie coronaire, caractérisée par une absence de débris pulpaires et un nettoyage très satisfaisant des canalicules dentinaires.25 Chen a décrit des études cliniques utilisant uniquement un laser Er,Cr:YSGG, le premier laser à avoir obtenu l’agrément de la FDA, pour le traitement endodontique complet (élargissement, nettoyage et décontamination), pour effectuer une préparation corono-apicale avec une série de tubes successifs de 400, 320 et 200 μm et des réglages de 1,5 W et 20 Hz (en présence d’une pulvérisation air/eau de 35/25 %).26,27
Stabholz et al. ont présenté des résultats positifs d’un traitement entièrement réalisé au moyen d’un laser Er:YAG, et de microsondes endodontiques à émission latérale.28,29 Ali et al., Matsuoka et al., ainsi que Jahan et al. se sont servis d’un laser Er, Cr:YSGG pour préparer des canaux droits et courbés. Mais dans ces cas, les résultats du groupe expérimental étaient plus mauvais que ceux du groupe témoin. L’utilisation du laser Er,Cr:YSGG avec des tubes de 200 à 320 μm, à des réglages de 2 W et 20 Hz, pour le traitement de canaux tant droits que courbés, les a menés à conclure que le rayonnement laser permet de préparer ce type de canaux jusqu’à une courbure maximale de 10°, mais qu’il provoque des effets secondaires dans les canaux plus fortement courbés, notamment des perforations, des brûlures et un transport du canal.21–23 Inamoto et al. ont étudié la capacité de coupe et les effets morphologiques du rayonnement laser Er:YAG in vitro, à 30 mJ - 10 et 25 Hz, avec une vitesse de retrait du tube, réglée à 1 et 2 mm/seconde. Les résultats ont de nouveau été favorables.30 Minas et al. ont également rapporté des résultats positifs avec le laser Er,Cr:YSGG à 1,50 W, 1,75 W et 2,0 W, 20 Hz, en présence d’une pulvérisation d’eau.31
Les surfaces préparées avec le laser Erbium étaient bien nettoyées et exemptes de boue dentinaire, mais présentaient souvent des saillies, des irrégularités et des éléments calcinés, associés au risque de perforations ou de transport apical. En effet, la mise en forme du canal par le laser Erbium est encore actuellement une procédure compliquée, qui ne peut être réalisée que dans des canaux droits de grand diamètre, sans aucun avantage particulier.
Décontamination du système endodontique
Les études sur la décontamination canalaire se limitent à l’action des produits chimiques d’irrigation (hypochlorite de sodium [NaClO]), fréquemment utilisés en endodontie et associés à des agents chélatants, aux fins d’un meilleur nettoyage des canalicules dentinaires (acide citrique et acide éthylène diamine tétraacétique [EDTA]). L’une de ces études a été menée par Berutti et al., qui ont démontré le pouvoir décontaminant de NaClO sur la paroi radiculaire, jusqu’à une profondeur de 130 μm.32 À l’origine, l’introduction des lasers en endodontie visait principalement un renforcement de la décontamination du système endodontique.2–7
Toutes les longueurs d’onde ont une action bactéricide élevée, en raison de leur effet thermique. À différentes puissances et différents pouvoirs de pénétration des parois dentinaires, elles induisent d’importantes modifications structurelles dans les cellules bactériennes. La membrane cellulaire est la première atteinte par un changement du gradient osmotique, qui mène à un gonflement et la mort des cellules.16,34
embedImagecenter("Imagecenter_1_1017",1017, "large");
Décontamination par le laser émettant dans le proche infrarouge
La décontamination canalaire réalisée au moyen d’un laser émettant dans le proche infrarouge, nécessite une préparation des canaux selon les modalités classiques (préparation apicale avec lime ISO 25/30), étant donné que cette longueur d’onde ne présente aucune affinité pour le tissu dur et n’a donc pas d’effet ablatif. L’exposition au rayonnement suit la préparation endodontique classique, et sert de moyen de décontamination final du système endodontique avant l’obturation. Une fibre optique de 200 μm de diamètre est placée à 1 mm de l’apex, puis retirée avec un mouvement hélicoïdal en direction coronaire (le retrait étant effectué en cinq à dix secondes selon les techniques). Aujourd’hui, il est conseillé d’accomplir cette procédure dans un canal rempli d’un produit d’irrigation endodontique (de préférence, l’EDTA ou l’acide citrique; sinon du NaClO), afin de réduire les effets thermiques indésirables sur la morphologie.9,35–38
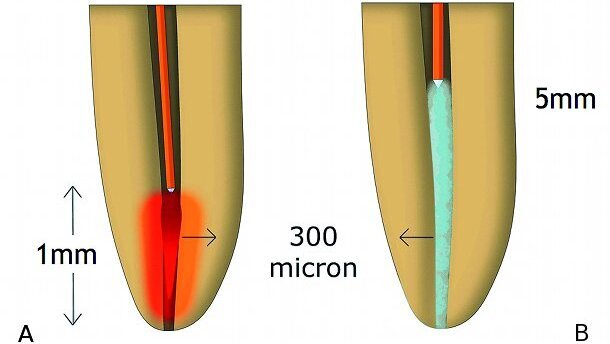
Un modèle expérimental a permis à Schoop et al. de démontrer que la manière avec laquelle les lasers diffusent leur énergie et pénètrent dans les parois dentinaires, les rend physiquement plus efficaces que les systèmes classiques d’irrigation chimique, pour décontaminer ces parois.8 Le laser au néodyme: YAG (Nd:YAG ; 1 064 nm) a permis de réduire la population bactérienne de 85 % à une profondeur de 1 mm, par rapport à la diode laser (810 nm), dont le passage n’a mené qu’à une réduction de 63 % à 750 μm ou moins. Cette nette différence du pouvoir de pénétration est due à l’affinité faible et variable de ces longueurs d’onde pour le tissu dur. La non-uniformité de la capacité de diffusion permet à la lumière pénétrant dans le tissu d’atteindre les bactéries et de les détruire par le biais des effets thermiques (Fig. 5).
Beaucoup d’autres études microbiologiques ont confirmé la puissante action bactéricide de la diode laser et du laser Nd:YAG, capables d’éliminer jusqu’à 100 % de la charge bactérienne dans le canal principal.39–43 Une étude in vitro réalisée par Benedicenti et al., a indiqué que l’utilisation de la diode laser de 810 nm associée à des solutions d’irrigation à base d’agents chélatants, tels que l’acide citrique et l’EDTA, menait à une réduction plus ou moins absolue de l’espèce E. faecalis (99,9 %) dans le système endodontique.9
Décontamination par un laser émettant dans le moyen infrarouge
Vu sa faible efficacité pour la préparation et la mise en forme des canaux, l’utilisation du laser Erbium pour la décontamination endodontique requiert une préparation canalaire par des techniques classiques, notamment une préparation de l’apex au moyen d’instruments ISO 25/30. Le dernier passage avec le laser n’est possible que si le dispositif est équipé de longs tubes très fins (200 et 320 μm). Ceux-ci sont disponibles pour divers lasers Erbium et permettent d’atteindre plus facilement la longueur de travail (1 mm à partir de l’apex). Cette technique utilise classiquement un mouvement hélicoïdal lors du retrait du tube (sur un intervalle de cinq à dix secondes). Le passage du laser est répété trois à quatre fois selon la procédure, en alternant le rayonnement avec une irrigation par des produits chimiques (NaClO et/ou EDTA), pour maintenir l’humidité du canal. Pendant la procédure, le système de pulvérisation intégré est fermé.
La décontamination tridimensionnelle du système endodontique par le laser Erbium, n’est pas encore comparable à celle des lasers émettant dans le proche infrarouge. L’énergie thermique générée par ce type de laser est en fait essentiellement absorbée à la surface (haute affinité pour le tissu dentinaire riche en eau), où l’effet bactéricide sur E. coli (bactérie à Gram négatif), et E. faecalis (bactérie à Gram positif) est le plus élevé. Moritz et al. ont obtenu une éradication presque totale (99,64 %) de ces bactéries, avec un réglage de 1,5 W.44 Toutefois, ces systèmes n’ont aucune action bactéricide en profondeur dans les canaux latéraux, car les tests sur la paroi radiculaire montrent qu’ils n’y pénètrent pas au-delà de 300 μm.8
D’autres études ont examiné le pouvoir de décontamination du laser Er,Cr:YSGG dans les canaux préparés de manière traditionnelle. L’utilisation d’une basse puissance (0,5 W, 10 Hz, 50 mJ, en présence d’une pulvérisation air/eau de l’ordre de 20 %) a permis l’élimination totale des bactéries. Cependant, le laser Er,Cr:YSGG a réalisé de meilleurs résultats, avec 77 % de réduction à 1 W et 96 % à 1,5 W.42
Un nouveau domaine de recherche est celui de la capacité du laser Erbium à éliminer le biofilm bactérien du tiers apical.46 Une étude in vitro récente a davantage validé la capacité du laser Er:YAG à éliminer le biofilm endodontique de nombreuses espèces bactériennes (notamment A. naeslundii, E. faecalis, L. casei, P. acnes, F. nucleatum, P. gingivalis ou P. nigrescens). Les résultats ont indiqué une considérable réduction des cellules bactériennes et une désagrégation du biofilm, la seule exception étant le biofilm formé par L. casei.47
Les études menées actuellement évaluent l’efficacité d’une nouvelle technique laser qui fait intervenir une conception récente de tube nu, conique et à émission radiale. L’objectif est d’éliminer non seulement la boue dentinaire mais aussi le biofilm bactérien,13 et les résultats sont très encourageants.
Les lasers Erbium équipés de tubes à « tir frontal » – émission de lumière à l’extrémité du tube – ont un faible pouvoir de pénétration latérale dans la paroi dentinaire. L’utilisation d’un tube à émission radiale avec le laser Er,Cr:YSGG a été proposée en 2007, et Gordon et al. ainsi que Schoop et al., ont étudié les effets de ce système sur la morphologie et la décontamination (Fig. 6).48–50
La première étude utilisait un tube de 200 μm de diamètre à émission radiale, avec et sans pulvérisation air/eau (34 et 28 %), à 10 et 20 mJ, 20 Hz (0,2 et 0,4 W, respectivement). La durée du rayonnement variait de 15 secondes à deux minutes. La meilleure action bactéricide a été obtenue à la puissance maximale (0,4 W), avec un temps d’exposition prolongé, en mode sec sans pulvérisation d’eau. Elle correspondait à 99,71 % d’élimination de la population bactérienne. Le rayonnement de durée et de puissance minimales (15 secondes et 0,2 W) avec pulvérisation d’eau, a permis d’obtenir 94,7 % de réduction.48
La seconde étude portait sur un tube de 300 μm de diamètre et deux paramètres différents d’émission laser (1 et 1,5 W, 20 Hz). Le protocole d’essai consistait en cinq passages d’une durée de cinq secondes, chacun interrompu par un temps de refroidissement de 20 secondes. Le niveau de décontamination obtenu a été extrêmement élevé, avec des différences sensibles entre 1 et 1,5 W, et une hausse thermique comprise entre 2,7 et 3,2 °C.49 Le même groupe, basé à Vienne, a étudié d’autres paramètres (0,6 et 0,9 W) qui ont conduit à une hausse thermique très bien maîtrisée de 1,3 et 1,6 °C respectivement, indiquant un effet bactéricide important sur E. coli et E. faecalis.50
La nécessité de faire intervenir l’effet thermique pour détruire les cellules bactériennes, entraîne toutefois des modifications de la dentine et du parodonte. Il importe d’évaluer les paramètres les plus favorables et d’explorer de nouvelles techniques, qui réduisent à un minimum les effets thermiques indésirables, que les lasers induisent sur les structures tissulaires dures et molles.
Effets morphologiques sur la surface dentinaire
De nombreuses études se sont penchées sur les effets morphologiques du rayonnement laser sur les parois radiculaires, en évaluant les effets collatéraux de la décontamination et du nettoyage des canaux radiculaires par différents lasers. Lorsqu’ils sont utilisés à sec, les lasers émettant dans le proche et le moyen infrarouge produisent des effets thermiques caractéristiques (Figs. 7 et 8).51 Les lasers émettant dans le proche infrarouge provoquent des modifications morphologiques caractéristiques de la paroi dentinaire : la boue dentinaire n’est que partiellement éliminée et les canalicules dentinaires sont fermés, surtout en raison de la fonte des structures dentinaires inorganiques. La présence de bulles de recristallisation et de fêlures est manifeste (Figs. 9-12).52-55
L’eau présente dans les solutions d’irrigation limite l’interaction thermique du faisceau laser sur la paroi dentinaire, mais parallèlement, elle peut avoir une action spécifique (désinfection ou chélation), en raison de sa thermo-activation par un laser émettant dans le proche infrarouge, ou de sa vaporisation directe par un laser émettant dans le moyen infrarouge (cible chromophore). L’exposition au rayonnement laser dans le proche infra-rouge — diode (2,5 W, 15 Hz) et Nd:YAG (1,5 W, 100 mJ, 15 Hz) — après l’utilisation d’une solution d’irrigation, crée un meilleur schéma dentinaire, similaire à celui qui est obtenu avec un agent d’irrigation employé seul.
En présence de NaClO ou de chlorhexidine, le rayonnement laser conduit à une morphologie de canalicules dentinaires fermés contenant une boue dentinaire, mais la surface de fonte est réduite par comparaison avec la carbonisation résultant de l’exposition à sec. Les meilleurs résultats ont été obtenus lors d’un rayonnement suivi d’une irrigation avec de l’EDTA, qui a nettoyé les surfaces de la boue dentinaire, ouvert les canalicules dentinaires et causé moins de signes observables de dommages thermiques.35–38 Dans la conclusion de leurs études sur le laser Erbium, Yamazaki et al., ainsi que Kimura et al., ont souligné le besoin d’eau pour éviter les effets morphologiques indésirables, manifestement présents lors d’une exposition aux lasers Erbium dans des conditions sèches.56,57 Utilisés de cette manière, les lasers Erbium donnent lieu à des signes d’ablation et de dommages thermiques, sous l’effet de la puissance utilisée. On observe des traces visibles de fêlures, de fonte superficielle de certaines surfaces et de vaporisation de la boue dentinaire.
L’exposition de la dentine au rayonnement du laser Erbium en présence d’eau, crée un schéma caractéristique. Le dommage thermique est réduit et les canalicules dentinaires sont ouverts au sommet des espaces péricanaliculaires, plus calcifiés et moins ablatés. La dentine intercanaliculaire, plus riche en eau, est davantage éliminée. La boue dentinaire est vaporisée par le rayonnement des lasers Erbium et généralement absente.58–64 Shoop et al. ont réalisé une étude in vitro des variations de température à la surface radiculaire. Ils ont trouvé que les niveaux énergétiques normalisés (100 mJ, 15 Hz, 1,5 W), produisent une élévation thermique de 3,5 °C seulement, à la surface du parodonte. Moritz a déclaré que ces paramètres étaient un moyen efficace de nettoyer et de décontaminer les canaux, et les a proposés comme norme internationale d’utilisation du laser Erbium en endodontie (Figs. 13-16).14,16
Même avec les lasers Erbium, il est conseillé d’utiliser des solutions d’irrigation, sinon il est possible d’utiliser le NaClO et l’EDTA pendant la phase finale du traitement endodontique assisté par laser, et d’obtenir un schéma dentinaire avec peu d’effets thermiques. Ceci ouvre la voie d’un nouveau domaine de recherche en endodontie assistée par laser. Diverses techniques ont été proposées, telles que l’irrigation activée par laser (LAI) et le flux photo-acoustique induit par l’absorption de photons (PIPS).
Phénomènes photothermiques et photomécaniques de l’élimination de la boue dentinaire
George et al. ont publié la première étude sur l’activation laser des liquides d’irrigation, introduits à l’intérieur du canal radiculaire en vue d’augmenter leur efficacité. Dans cette étude, des tubes de deux systèmes laser (Er:YAG et Er,Cr:YSGG, tubes de 400 μm de diamètre, extrémités plates et coniques), dont le revêtement externe de protection mécanique avait été supprimé chimiquement, ont été utilisés pour accroître la diffusion latérale de l’énergie.
Le protocole de l’étude consistait à tester le rayonnement laser sur des canaux radiculaires dont l’espace interne avait été préparé avec une couche dense de boue dentinaire développée expérimentalement. La comparaison des résultats obtenus dans les groupes exposés au laser avec ceux des groupes non exposés, a permis de conclure que l’activation laser de solutions d’irrigation (EDTA associé au cétrimide, ou EDTAC, en particulier) permet un meilleur nettoyage et une élimination plus complète de la boue, des surfaces dentinaires.65 Une étude ultérieure a indiqué que cette technique, appliquée à une puissance de 1 et 0,75 W, occasionne une élévation de température de 2,5°C seulement, sans atteinte des structures parodontales.66 Blanken et De Moor ont également étudié les effets de l’activation de solutions d’irrigation par le laser. Ils les ont comparés avec l’irrigation conventionnelle (CI) et l’irrigation passive aux ultrasons (PUI). Dans cette étude, un tube endodontique (200 μm de diamètre, extrémité plate), maintenu à 5 mm de l’apex, a été utilisé pour effectuer quatre passages du laser Er,Cr:YSGG, en présence de NaClO à 2,5 %, chacun d’une durée de cinq secondes, à 75 mJ, 20 Hz, 1,5 W.
L’élimination de la boue dentinaire par cette technique a produit des résultats bien meilleurs que les deux autres méthodes.67 L’étude photo-micrographique de l’essai semble indiquer que le laser provoque un déplacement très rapide des liquides par un effet de cavitation. La dilatation et la contraction successive des solutions d’irrigation (sous l’effet thermique) génère un effet de cavitation secondaire sur les liquides intracanalaires. Il n’a pas été nécessaire d’imprimer un mouvement ascendant et descendant du tube dans le canal, mais de le maintenir suffisamment stable dans le tiers moyen, à 5 mm de l’apex.68 Ce concept simplifie fortement la technique laser, sans le besoin d’atteindre l’apex et de négocier les courbes radiculaires (Fig. 17a).
De Moor et al. ont comparé les techniques LAI et PUI et ont conclu que l’utilisation du laser, en présence de durées d’irrigation plus courtes (quatre irrigations de cinq secondes), donne des résultats comparables à ceux de la technique par ultrasons, où les temps d’irrigation sont plus longs (trois fois 20 secondes).69 De Groot et al. ont également confirmé l’efficacité de la technique LAI et les résultats plus avantageux par rapport à la technique PUI. Les auteurs ont mis l’accent sur le concept de flux, résultant de l’effondrement des molécules d’eau dans les solutions d’irrigation utilisées.70
Hmud et al. ont examiné la possibilité d’utiliser les lasers émettant dans le proche infrarouge (940 et 980 nm) avec un embout de 200 μm, pour activer les solutions d’irrigation à des puissances de 4 W et 10 Hz, et 2,5 W et 25 Hz, respectivement. Vu le manque d’affinité entre ces longueurs d’onde et l’eau, il a été nécessaire d’utiliser des puissances plus élevées qui, via l’effet thermique et la cavitation, ont provoqué des mouvements liquidiens dans le canal radiculaire, ce qui a accru la capacité d’élimination des débris et de la boue dentinaire.71 Au cours d’une étude ultérieure, les auteurs ont également vérifié la sécurité d’emploi de ces puissances plus élevées, lesquelles ont causé une hausse de température de 30 °C dans la solution d’irrigation intracanalaire, alors qu’elle n’a été que de 4 °C sur la surface radiculaire externe. L’étude a conclu que l’irrigation activée par les lasers émettant dans le proche infrarouge, est très efficace pour minimiser les effets thermiques sur la dentine et le cément radiculaire.72 Une étude réalisée récemment par Macedo et al. portait sur le rôle d’activation fondamental d’un puissant modulateur de la vitesse de réaction de NaClO. Durant une pause de trois minutes, la consommation du chlore disponible a considérablement augmenté après la technique LAI, par rapport à PUI ou CI.73
Flux photo-acoustique induit par l’absorption de photons (PIPS)
La technique PIPS présuppose l’utilisation du laser Erbium (Powerlase AT/HT et LightWalker AT, tous deux de Fotona) et son interaction avec des solutions d’irrigation (EDTA ou eau distillée).13 La technique fait intervenir un mécanisme différent de la technique LAI précédemment citée. Elle exploite les phénomènes photoacoustiques et photomécaniques exclusivement, lesquels découlent de l’utilisation de l’énergie subablative de 20 mJ à 15 Hz, avec des impulsions de 50 μs uniquement. Avec une puissance moyenne de seulement 0,3 W, chaque impulsion interagit avec les molécules d’eau à une puissance de crête de 400 W, ce qui provoque une dilatation et des « ondes de choc » successives, et la formation d’un puissant flux de liquides à l’intérieur du canal, sans générer les effets thermiques indésirables observés avec d’autres techniques.
L’étude de thermocouples appliqués au tiers radiculaire apical, a indiqué une élévation thermique de 1,2 °C après 20 secondes, et de 1,5 °C après 40 secondes de rayonnement continu. Un autre grand avantage découle de l’insertion du tube dans la chambre pulpaire, qui se limite à l’entrée du canal radiculaire uniquement et évite la pénétration toujours problématique du tube dans le canal ou jusqu’à 1 mm de l’apex, comme le requièrent les autres techniques (LAI et CI). On utilise à cet effet des tubes de conception récente (12 mm de long, 300 à 400 μm de diamètre et extrémités « nues et à émission radiale »). Les 3 derniers millimètres sont dépourvus de revêtement de protection, afin de favoriser une émission énergétique latérale plus importante par rapport au tube à émission frontale. Ce mode d’émission améliore l’utilisation de l’énergie du laser lorsque, à des niveaux subablatifs, un faisceau ayant une puissance de crête très élevée pour chaque impulsion de 50 μs (400 W) génère de puissantes « ondes de choc » dans les solutions d’irrigation, et produit un effet mécanique manifeste et significatif sur la paroi dentinaire (Figs. 18–20).
Les études indiquent que l’élimination de la boue dentinaire est supérieure à celle des groupes témoins où seuls de l’EDTA ou de l’eau distillée a été utilisé. Les échantillons traités par laser et EDTA pendant 20 et 40 secondes présentent une élimination totale de la boue dentinaire et des canalicules dentinaires (score de 1, selon Hulsmann) ainsi qu’une absence d’effets thermiques indésirables, caractéristiques des parois dentinaires traitées par les techniques laser classiques. Observé à un fort grossissement, la structure du collagène reste intacte, ce qui semble indiquer un traitement endodontique très peu traumatisant (Figs. 21–23). Le Medical Dental Advanced Technologies Group, en collaboration avec l’école Arizona School of Dentistry and Oral Health (A. T. Still University), l’école Arthur A. Dugoni School of Dentistry (University of the Pacific), l’université de Gênes et l’université Loma Linda School of Dentistry, cherche actuellement à déterminer les effets de cette technique de décontamination du canal radiculaire et de l’élimination du biofilm bactérien dans ce canal. Les résultats dont on dispose sont très encourageants (Figs. 24–29).
_Discussion et conclusion
La technologie laser utilisée en endodontie au cours des 20 dernières années a fortement évolué. Ses perfectionnements ont introduit les fibres optiques et tubes endodontiques, dont le calibre et la souplesse permettent de les insérer jusqu’à 1 mm de l’apex. La recherche menée au cours des dernières années s’est orientée vers l’élaboration de technologies (impulsions courtes, tubes nus et à « tir radial ») et de techniques (LAI et PIPS), susceptibles de simplifier l’utilisation du laser en endodontie, et de minimiser les effets thermiques indésirables sur les parois dentinaires, grâce à l’utilisation d’une puissance plus faible en présence de produits chimiques d’irrigation. Il s’est avéré que l’EDTA est la meilleure solution en technique LAI, qui active le liquide et augmente l’efficacité de son agent chélatant, ainsi que le nettoyage de la boue dentinaire. L’utilisation de NaClO augmente l’effet décontaminant. La technique PIPS atténue quant à elle les effets thermiques et permet d’obtenir une puissante activité bactéricide et de nettoyage, grâce à son flux de liquides induit par l’énergie photonique du laser. D’autres études sont nécessaire pour valider l’aspect innovateur de ces techniques (LAI et PIPS) en endodontie moderne._
Note de la rédaction :
- une liste complète des références est disponible auprès de l’éditeur.
- La partie I de cet article a été publiée dans le magazine DT Study Club, Vol. 1, No. 2, septembre 2013. La partie II dans le magazine DT Study Club, Vol. 1, N°. 3, décembre 2013.
Fig. 5_Position de la fibre optique du laser émettant dans le proche infrarouge à 1 mm de l’apex, et pénétration différente de la paroi dentinaire par le laser Nd:YAG et la diode laser 810 nm (à droite).
Fig. 6_Tube à tir radialpour laser Er,Cr:YSGG.
Fig. 7_Effets thermiques indésirables pendant le mouvement de retrait de la fibre optique d’un laser Nd:YAG dans un canal sec. Le contact avec la paroi dentinaire peut causer des brûlures.
Fig. 8_Effets thermiques indésirables : pendant le mouvement de retrait d’un tube pour laser Er,Cr:YSGG utilisé selon une technique traditionnelle, le tube mis en contact avec la paroi dentinaire sèche est responsable de brûlures, de saillies et d’un transport des canaux.
Figs. 9 & 10_Images SEM de la dentine exposée au laser Nd:YAG (à sec,1,5 W,15 Hz). À noter : les importantes surfaces de fonte dentinaire et les bulles.
(Figures 9–16 reproduites avec l’aimable autorisation du Pr Vasilios Kaitsas, université Aristote de Thessalonique, Grèce.)
Figs. 11 & 12_Images SEM de la dentine exposée à la diode laser 810 nm (à sec, 1,5 W, 15 Hz) avec 50 % de temps de pause/temps de tir (tON-tOFF) et fibre optique de 200 μm, montrant des signes d’effets thermiques, avec détachement et boue dentinaire.
Figs. 13 & 14_Images SEM de la dentine exposée au laser Er,Cr:YSGG (1,0 W, 20 Hz, 1 mm de l’apex), pulvérisation inactivée et canal irrigué avec une solution physiologique, montrant des signes de boue dentinaire et de dommage thermique.
Figs. 15 & 16_Images SEM de la dentine exposée au laser Er,Cr:YSGG (1,5 W, 20 Hz) avec pulvérisation air/eau à 45/35 %. Les canalicules dentinaires sont ouverts sans signe de boue dentinaire. À noter : le schéma caractéristique de l’ablation par laser, tout à la fois sur la dentine organique et inorganique.
Fig. 17_Position de la fibre optique et d’un tube de laser émettant dans le proche et moyen infrarouge, à 1 mm de l’apex. Selon la technique LAI, l’extrémité doit se trouver dans le tiers moyen du canal, à environ 5 mm de l’apex (à droite).
Figs. 18–20_Tube pour technique PIPS, à tir radial, en quartz, 400 μm. Les 3 derniers millimètres ont été dénudés du revêtement de protection externe, afin d’augmentation la dispersion latérale d’énergie.
Figs. 21–23_Images SEM de la dentine exposée à un tube à tir radial, 20 et 50 mJ, 10 Hz pendant 20 et 40 secondes, respectivement, dans un canal irrigué avec de l’EDTA. On observe un nettoyage visible des débris, de la boue dentinaire de la dentine et de la structure du collagène. (Figures reproduites avec l’aimable autorisation du Dr Enrico Divito, États-Unis.)
Fig. 24_Images SEM de la dentine radiculaire recouverte d’un biofilm bactérien de E. faecalis, avant le rayonnement laser.
Figs. 25 & 26_Images SEM de la dentine radiculaire recouverte d’un biofilm bactérien de E. faecalis, après le rayonnement laser Er:YAG (20 mJ, 15 Hz, tube pour PIPS) avec irrigation (EDTA). On observe une destruction et un détachement du biofilm bactérien et sa totale vaporisation du canal radiculaire principal et des canaux latéraux. (Figures 25–29d reproduites avec l’aimable autorisation des Drs Enrico Divito et David Jaramillo, États-Unis.)
Figs. 27a–d_Images au microscope confocal de la dentine du canal radiculaire recouverte d’un biofilm (a). Cliché en lumière fluorescente du biofilm bactérien (en vert ; b). Signal autofluorecent
de la dentine (en rouge ; c). Cliché 3D en surimpression (d).
Figs. 28a–d_Images au microscope confocal de la dentine des canaux latéraux recouverte d’un biofilm (a). Cliché en lumière fluorescente du biofilm bactérien (en vert ; b). Signal autofluorecent de la dentine (en rouge ; c). Cliché 3D en surimpression (d).
Figs. 29a–d_Images au microscope confocal de la dentine (a). Signal autofluorescent sans signe de bactéries (b et c). Cliché 3D en surimpression (d).
_Les objectifs principaux d’un traitement endodontique sont le nettoyage efficace du système canalaire. Les techniques conventionnelles ...
Dans une publication précédente les principales caractéristiques d’un laser diode, original parce que couplant plusieurs ...
Les lasers diodes rencontrent un certain succès en odontologie pour diverses raisons parmi lesquelles leur faible encombrement, leur utilisation ...
Quand on parle de perception tactile, la plupart des dentistes qui font de l'endodontie sont d'accord pour dire que c'est mieux. Mais que ce signifie-t-il ...
La première application de la technologie laser en dentisterie a été décrite par Goldman en 1964, quatre années ...
Une introduction à l’acupuncture et ses applications pratiques dans un cabinet dentaire moderne.
La première partie de cet article décrivait la symbolique des dents, surtout celle des canines, en termes de bien-être et de santé. Dans la seconde ...
L’éternel problème de désinfection du système canalaire est toujours d’actualité. La colonisation de l’endodonte n’est pas...
Les principaux problèmes que le chirurgien-dentiste peut rencontrer au cours de ses traitements sont en général de deux ordres : ...
La perfection de la technique endodontique n'est rien sans la prise en compte de la biologie
Webinaire en direct
mar. le 24 février 2026
à 19h00 (CET) Paris
Prof. Dr. Markus B. Hürzeler
Webinaire en direct
mar. le 24 février 2026
à 21h00 (CET) Paris
Prof. Dr. Marcel A. Wainwright DDS, PhD
Webinaire en direct
mer. le 25 février 2026
à 17h00 (CET) Paris
Prof. Dr. Daniel Edelhoff
Webinaire en direct
mer. le 25 février 2026
à 19h00 (CET) Paris
Webinaire en direct
jeu. le 26 février 2026
à 2h00 (CET) Paris
Webinaire en direct
mar. le 3 mars 2026
à 17h00 (CET) Paris
Dr. Omar Lugo Cirujano Maxilofacial
Webinaire en direct
mer. le 4 mars 2026
à 2h00 (CET) Paris
Dr. Vasiliki Maseli DDS, MS, EdM



 Autriche / Österreich
Autriche / Österreich
 Bosnie Herzégovine / Босна и Херцеговина
Bosnie Herzégovine / Босна и Херцеговина
 Bulgarie / България
Bulgarie / България
 Croatie / Hrvatska
Croatie / Hrvatska
 République tchèque et Slovaquie / Česká republika & Slovensko
République tchèque et Slovaquie / Česká republika & Slovensko
 France / France
France / France
 Allemagne / Deutschland
Allemagne / Deutschland
 Grèce / ΕΛΛΑΔΑ
Grèce / ΕΛΛΑΔΑ
 Hongrie / Hungary
Hongrie / Hungary
 Italie / Italia
Italie / Italia
 Pays-Bas / Nederland
Pays-Bas / Nederland
 Nordique / Nordic
Nordique / Nordic
 Pologne / Polska
Pologne / Polska
 Portugal / Portugal
Portugal / Portugal
 Roumanie & Moldavie / România & Moldova
Roumanie & Moldavie / România & Moldova
 Slovénie / Slovenija
Slovénie / Slovenija
 Serbie et Monténégro / Србија и Црна Гора
Serbie et Monténégro / Србија и Црна Гора
 Espagne / España
Espagne / España
 Suisse / Schweiz
Suisse / Schweiz
 Turquie / Türkiye
Turquie / Türkiye
 Royaume-Uni et Irlande / UK & Ireland
Royaume-Uni et Irlande / UK & Ireland
 International / International
International / International
 Brésil / Brasil
Brésil / Brasil
 Canada / Canada
Canada / Canada
 Amérique latine / Latinoamérica
Amérique latine / Latinoamérica
 États-Unis / USA
États-Unis / USA
 Chine / 中国
Chine / 中国
 Inde / भारत गणराज्य
Inde / भारत गणराज्य
 Pakistan / Pākistān
Pakistan / Pākistān
 Vietnam / Việt Nam
Vietnam / Việt Nam
 ANASE / ASEAN
ANASE / ASEAN
 Israël / מְדִינַת יִשְׂרָאֵל
Israël / מְדִינַת יִשְׂרָאֵל
 Algérie, Maroc et Tunisie / الجزائر والمغرب وتونس
Algérie, Maroc et Tunisie / الجزائر والمغرب وتونس
 Moyen-Orient / Middle East
Moyen-Orient / Middle East

























































To post a reply please login or register